Deontología profesional en Información Médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas
Professional ethics of Medical Information in the pharmaceutical industry: On the road to a Spanish code of good practice
Mónica Rojo Abril*,
monica.rojo@grunenthal.com
Miembro del Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica (AMIFE).
* Grünenthal Pharma, S.A. Madrid, Spain
Resumen
Introducción: En España, la Industria Farmacéutica es uno de los principales proveedores de Información Médica dentro del ámbito de la salud. En su compromiso con el servicio que proporcionan, los Técnicos de Información Médica (TIM) echan en falta un marco deontológico que guíe su actividad y garantice la calidad, la equidad y el equilibrio de la información que proporcionan a los profesionales sanitarios.
Objetivo: En su camino hacia un código español de buenas prácticas, el Grupo de Trabajo de Información Médica de la Asociación de Médicina de la Industria Farmacéutica (AMIFE) quiere presentar a la comunidad profesional el marco deontológico en que se manifiesta su reflexión ética, así como establecer los puntos de partida sobre los que afronta la elaboración de un texto accesible a todos los profesionales del sector y a las empresas que proporcionan y respaldan sus actividades.
Palabras clave
Información Médica; Buenas prácticas; Deontología profesional; Industria Farmacéutica
Abstract
Introduction: In Spain, the pharmaceutical industry is one of the leading providers of Medical Information services. Deeply committed to this service, the Medical Information Specialists (TIM, for its acronym in Spanish) miss an ethical framework to guide their activity and ensure the quality, equity and balance of information provided to healthcare professionals.
Objective: On the way to a Spanish code of professional guidelines, the Medical Information Working Group of the Spanish Pharmaceutical Industry wants to introduce the ethical framework in which its deontological reflection is materialized. With this paper, the members of this forum also want to establish the starting point from which they face the publishing of an accessible text to all professionals and companies that provide and support their activities.
Keywords
Medical information; guideline; professional ethics and deontology; pharmaceutical industry
|
Recibido: 26/05/2016 Aceptado:12/06/2016 DOI: http://dx.doi.org/10.5557/IIMEI7-N12-043-068 Descripción propuesta: ROJO ABRIL, Mónica, 2016. Deontología profesional en Información Médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas. Métodos de Información [en línea], 7(12), pp. 41-65. |
1. Deontología profesional en Información Médica. Qué y por qué.
Toda profesión y, por ende todo profesional, requiere de un marco normativo en el que plasmar la ética de una forma práctica. Cierto es que podríamos pensar que para eso existe la legislación vigente, pero a menudo la ley va por detrás (y a veces en contra) de la ética o de las necesidades reguladoras de casi cualquier grupo humano. No es de extrañar, por tanto, que los colectivos profesionales sientan la necesidad de ampararse bajo lo que llamamos deontología. Según la definición de Vázquez (2011), ésta es “el conjunto de reglas, normas, principios, presuposiciones y actitudes que regulan el ejercicio de una determinada profesión” y que a menudo superan el marco del mero cumplimiento de la ley. Y son las asociaciones y colegios profesionales los encargados de plasmar esta necesaria reflexión ética en ese conjunto normativo denominado Código Deontológico.
El ámbito de la Industria Farmacéutica y Biomédica no es muy diferente de otros. Sin embargo, lo que sí ha cambiado es la actitud y la participación de los profesionales sanitarios con respecto a la Información Médica (IM): durante los últimos 15 años, médicos, farmacéuticos y enfermeros han pasado de recibir pasivamente material promocional, fichas técnicas y prospectos a solicitar de forma proactiva información científica de calidad sobre los medicamentos que prescriben y administran a sus pacientes, las patologías concretas de sus especialidades médicas y los avances terapéuticos en las áreas de su competencia. Según datos extraídos de la encuesta realizada por el Grupo de Trabajo de Información Médica de la Asociación de Médicina de la Industria Farmacéutica (AMIFE) (Flores y Balmy 2015), el 62,8 % de las 81 empresas farmacéuticas y biomédicas españolas que respondieron el cuestionario reciben de media más de 500 consultas y solicitudes anuales de IM. En este escenario, los Técnicos de Información Médica (TIM) gestionan la información médica y científica relacionada con la actividad de sus empresas.
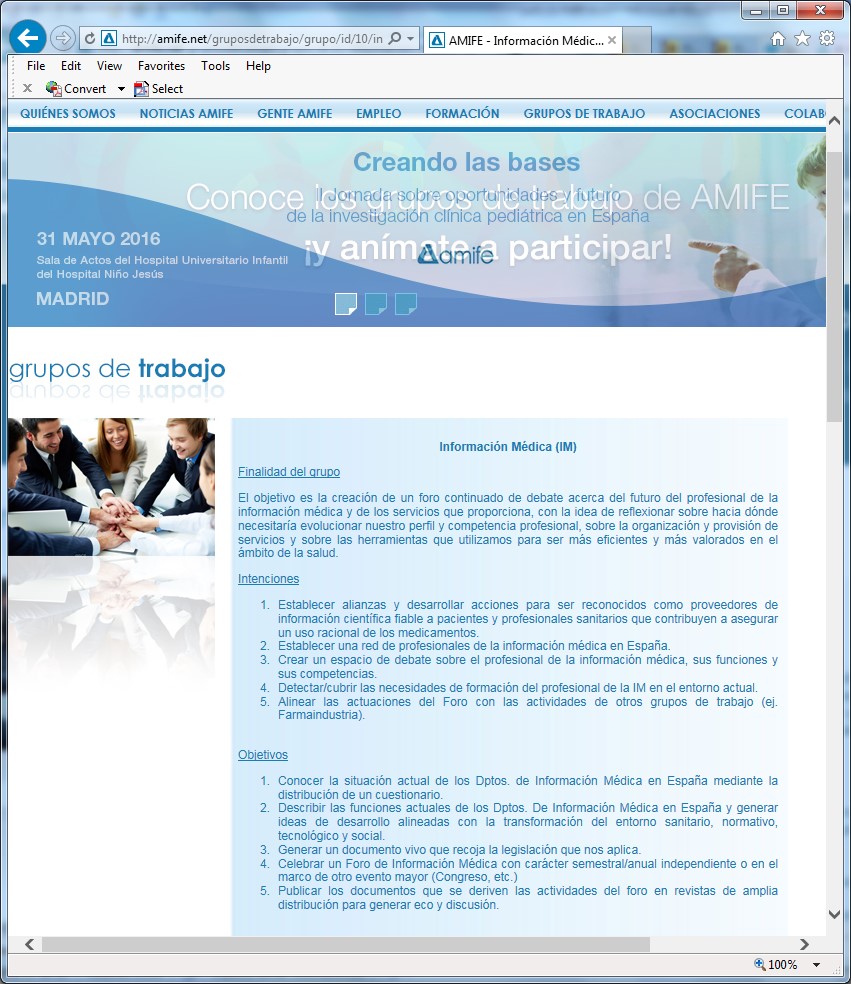
Desde finales del siglo XX, los TIM españoles se han involucrado en las asociaciones de farmacéuticos y médicos de la industria, pero su actividad como profesionales de la información les ha unido en grupos de trabajo cercanos a bibliotecarios y documentalistas (con la excepción del ya desaparecido grupo de trabajo de la Asociación Española de Farmacéuticos de la Industria, AEFI). Así, como respuesta a determinadas necesidades específicas de este colectivo, se crea en septiembre de 2014 el Foro de Información Médica de la Industria Farmacéutica. Bajo el patrocinio de la Asociación de Medicina de la Industria Farmacéutica (AMIFE), está formado por técnicos con larga experiencia en la información médico-científica, y tiene como primer objetivo mantener un debate continuado acerca del futuro del profesional de la Información Médica, centrándose en la reflexión sobre perfiles y competencias profesionales, la organización y provisión de los servicios que proporciona y las herramientas necesarias para desarrollar una actividad eficiente y mejor valorada dentro del ámbito de la salud (Figura 1).
Figura 1. Información sobre el Grupo de Trabajo de Información Médica en la página web de AMIFE http://amife.net/gruposdetrabajo/grupo/id/10/informacion-medica-im.html
2. Consideraciones legales sobre la Información Médica.
A la hora de encarar la redacción de una guía sobre Información Médica en la industria farmacéutica, es imprescindible hacer un repaso a la legislación en vigor y a los códigos deontológicos existentes.
De acuerdo con el concepto recogido por la Organización Mundial de la Salud (OMS) en sus Criterios éticos para la promoción de medicamentos (OMS 1998), la información médico-científica está englobada dentro del conjunto de actividades destinadas a fomentar un uso racional de los medicamentos. En este sentido, existe consenso entre los diferentes actores (profesionales sanitarios, industria farmacéutica, pacientes, consumidores, administraciones sanitarias, medios de información, etc.) sobre que esta información debe ser objetiva, rigurosa, transparente y respetuosa con los estándares éticos. Sin embargo, podemos afirmar que no existe en España una ley específica que regule la Información Médica proporcionada a los profesionales sanitarios y/o pacientes desde las empresas del sector farmacéutico, ya que el Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios (BOE 2015), sólo hace referencia a las actividades relacionadas con la promoción o publicidad de éstos.
Asimismo, de acuerdo con el Real Decreto 1416/1994, por el que se regula la publicidad de los medicamentos de uso humano (BOE 1994), la diferencia entre información y publicidad radica en su finalidad: sólo será publicidad aquella información que pretenda promover la prescripción, la dispensación, la venta o el consumo de un medicamento.
Por su parte, el Código de Buenas Prácticas de la Asociación Nacional Empresarial de la Industria Farmacéutica establecida en España (Farmaindustria 2014) (Figura 2) especifica que éste no aplica (entre otras) a las siguientes actividades:
- El etiquetado y prospecto de los medicamentos.
- La correspondencia, acompañada, en su caso, de cualquier documento no publicitario (por ejemplo, artículos científicos) necesario para responder a una pregunta concreta sobre un medicamento en particular, pero tan solo si se refiere a la cuestión objeto de consulta y es veraz y no engañosa.
- Las informaciones concretas y los documentos relativos, por ejemplo, al cambio de envase, a las advertencias sobre reacciones adversas en el marco de la farmacovigilancia, a los catálogos de ventas y a las listas de precios, siempre que no figure ninguna información sobre el medicamento. Tampoco cubre la información que el médico pueda facilitar al paciente en relación con determinados medicamentos que, por la complejidad de su posología, vía de administración, etc., requieran de la entrega de información adicional, y siempre que esta información tenga como objetivo mejorar el cumplimiento del tratamiento (…).
- La información sobre salud humana o enfermedades de las personas, siempre que no se haga referencia alguna, ni siquiera indirecta, a un medicamento.
Figura 2. Farmaindustria. Código de Buenas Prácticas de la Industria Farmacéutica. 2014

Como consecuencia, podemos afirmar que la Información Médica enviada desde las áreas científicas de las empresas farmacéuticas como respuesta a solicitudes específicas de los profesionales sanitarios queda fuera del concepto de promoción de medicamentos.
3. Códigos éticos y deontológicos de los profesionales de la información.
Si bien no nos extenderemos aquí sobre los códigos deontológicos bibliotecarios y de la documentación en general, no queremos dejar de mencionar la Library Bill of Rights de la American Library Association (ALA 2006). Ya desde su primera versión, aprobada en 1948, este texto se aproxima a la ética desde la Declaración Universal de los Derechos Humanos, en especial desde el derecho a la libertad de pensamiento y el de la libertad de opinión y expresión. Es a partir de su aprobación cuando comienza a desarrollarse una verdadera ética y deontología profesional específica sobre el aceso a la información.
Además, consideramos importante mencionar otros dos textos de especial relevancia:
El Código de Ética de la Federation of Library Associations and Institutions (IFLA) para bibliotecarios y otros trabajadores de la información (IFLA 2012), que resume en cinco puntos los valores fundamentales a seguir en el desarrollo de la profesión (acceso a la información; responsabilidad hacia las personas y la sociedad; privacidad, confidencialidad y transparencia; acceso abierto y propiedad intelectual; y neutralidad, integridad personal y habilidades profesionales); y el Código de Ética de las principales asociaciones portuguesas del sector de la información científica y en salud (APDIS, BAD e INCITE 1999) que, basado en tres principios fundamentales (libertad intelectual, privacidad de los usuarios y profesionalismo), pretende ser una referencia para la práctica profesional y fijar el “diseño y ejecución de las diversas tareas, comportamientos y contextos de actividad de su ejercicio”.
Desde un punto de vista empresarial, consideramos de especial trascendencia el que puede considerarse primer código deontológico a nivel europeo, aprobado bajo el amparo de la Comisión de las Comunidades Europeas como parte del programa IMPACT. Es el llamado Código de conducta para mediadores de información, elaborado por la European Association of Information Services (EUSIDIC) (Figura 3) con la colaboración de la European Information Industry Association (EIIA) y la European Information Researchers Network (EIRENE 1994). A efectos de nuestra actividad profesional como TIM de la industria farmacéutica y biomédica, su principal interés reside en la definición del mediador de información como “aquel individuo u organización que realiza búsquedas de información bajo petición, contesta preguntas utilizando todas las fuentes posibles, en especial las electrónicas, y trabaja este campo con fines comerciales fundamentalmente”.
Figura 3. EUSIDIC. Código de conducta para mediadores de información. 1994.

Se trata de un texto claro, breve y conciso que presta especial atención a la relación del mediador de información con el cliente-usuario, así como a la confianza en el servicio que el compromiso del primero con el código deontológico puede proporcionar al segundo. Además, amplía la consideración del profesional más allá del rol tradicional de bibliotecario o documentalista, incluyendo en el concepto de mediadior de información a consultores y especialistas en información, proveedores de información bajo demanda y servicios de información bajo tarifa, entre otros. Conviene destacar asimismo su mención específica a la dimensión comercial de los “servicios de información con fines lucrativos” (públicos o privados) y su reconocimiento de la existencia de profesionales que desarrollan su trabajo a título individual, no integrados de una empresa.
En cuanto a sus principios éticos, el texto consagra la integridad (entendida como confidencialidad, ética comercial y objetividad) y la calidad de servicio al cliente (buena práctica comercial, competencia profesional, confidencialidad, responsabilidad y prohibición de cualquier publicidad ilícita), aportando al profesional indicaciones concretas y muy valiosas sobre cómo debe o no desarrollar su actividad diaria.
En España, la reflexión ética y deontológica en torno a la recuperación y difusión de información se ha movido principalmente en torno a la biblioteca pública y los centros de documentación, no siendo hasta la década de 1990 que empezaron a publicarse los primeros estudios teóricos al respecto (López-López y Vives-Gràcia 2013).
En lo que se refiere a la aparición de códigos propios de asociaciones profesionales, la Asociación Multisectorial de la Información (ASEDIE) publica en 1999 el Código ético del sector de servicios de información electrónica (ASEDIE 1999); y en 2006 ve la luz el Codi deontològic del Col'legi Oficial de Bibliotecaris-Documentalistes de Catalunya (COBDC 2006). Ambos son considerados los primeros instrumentos deontológicos españoles verdaderamente profesionales y, como novedad, el código catalán recoge por primera vez en España la creación de una Comisión Deontológica dentro de la estructura del COBDC.
Diez años después nace el Grupo de Trabajo sobre Ética Profesional de la Sociedad Española de Documentación e Información Científica (SEDIC), cuyo objetivo principal es la “elaboración de un código deontológico que recoja valores y que sirva de referente en la actuación diaria de dichos profesionales, a la vez que represente a España y sus territorios en las correspondientes organizaciones internacionales” (SEDIC 2013).
Ya en 2011, en el marco de las XII Jornadas Españolas de Documentación, organizadas por la Federación Española de Sociedades de Archivística, Biblioteconomía, Documentación y Museística (FESABID), el Grupo de Trabajo de Ética Profesional de SEDIC presentó los resultados de una encuesta realizada a la comunidad profesional sobre ética en las organizaciones y en la gestión de la información y la documentación (Pérez-Pulido y Pérez-Fernández 2011). Entre sus conclusiones, cabe destacar que el 76% de los profesionales consideraron la ética como un elemento clave en el perfil del profesional de la información. Sin embargo, y a pesar de que el 88% de los encuestados respondió que los valores éticos tienen bastante o mucha importancia en sus instituciones, el 59% de ellos declaró que no existían en ellas proyectos o iniciativas relacionadas con los valores éticos.
Estos (y en este orden) fueron los destacados como “valores de mayor importancia” en su actividad profesional: la calidad del servicio, el acceso a la información, la privacidad, la libertad intelectual y la transparencia.
La principal consecuencia de esta encuesta fue la reafirmación del convencimiento de la profesión sobre la necesidad de un código deontológico para el gestor de la información y la documentación a nivel nacional. Así, apenas dos años después, el código se aprobó en Asamblea General (SEDIC 2013). Un mes más tarde, el documento fue sancionado por la Asamblea de FESABID, convirtiéndose en la referencia ética de las asociaciones profesionales españolas en el ámbito de la gestión de la información.
4. La deontología profesional en la Industria Farmacéutica y Biomédica.
En el ámbito de la legislación sanitaria, las actividades relacionadas con la promoción de medicamentos están profusamente reglamentadas, tanto a nivel nacional como internacional. Existen además códigos de buenas prácticas aprobados por la industria farmacéutica, muy interesada en autoregular sus relaciones con los profesionales sanitarios, las organizaciones públicas y las asociaciones de pacientes. Sin embargo, las referencias a la Información Médica son pocas y excesivamente concisas.
Desde una perspectiva internacional, el primer referente que conocemos es el Código de Buenas Prácticas de la International Federation of Pharmaceutical Manufacturers & Associations (IFPMA 2012), organización global no gubernamental y sin ánimo de lucro con sede en Suiza que representa a la industria farmacéutica que realiza investigación. Su última actualización, aprobada en 2012, dice textualmente que “Las compañías farmacéuticas son responsables de proporcionar datos precisos, equilibrados y científicamente válidos sobre los productos”, y describe exhaustivamente lo que debe ser el Procedimiento Operativo Estándar para la gestión de las reclamaciones sobre infracciones recibidas.
Pero el código más influyente en el ámbito de la Industria Farmacéutica europea es sin duda el Código de Promoción de Medicamentos de Prescripción de la European Federation of Pharmaceuthical Industries and Associations (EFPIA 2014) (Figura 4). Este texto abarca la promoción de medicamentos sujetos a receta médica de cara a profesionales sanitarios, así como las interacciones de éstos con las compañías farmacéuticas. Comúnmente conocido como EFPIA Health Care Profesionals Code, exhorta a los miembros de la asociación no sólo a cumplir con su código deontológico, sino también a establecer las estructuras y los procedimientos internos necesarios para garantizar su cumplimiento, la gestión de reclamaciones, la elaboración de códigos nacionales y la elaboración de informes anuales sobre su implantación, desarrollo y cumplimiento. Además, establece la existencia de un comité compuesto por representantes de las asociaciones nacionales, el cual monitorizará la adopción de los códigos locales, promoverá las buenas prácticas en las actividades empresariales y ayudará a los miembros a poner en práctica los principios éticos y deontológicos recogidos en el texto. Su última actualización (aprobada en junio del 2014) incluye un anexo titulado Guidelines for internet websites available to healthcare professionals, patients and the public in Europe (Directrices europeas para sitios web de internet disponibles para profesionales de la salud, pacientes y público en general), de especial interés en el actual contexto de globalización de la información favorecido por la generalización de internet.
Figura 4. Código de Promoción de Medicamentos de Prescripción de la European Federation of Pharmaceuthical Industries and Associations (EFPIA)

En España, Farmaindustria suscribió ya en 1991 el texto elaborado por la EFPIA, adaptándolo dos años después a las disposiciones introducidas por la Directiva 92/28/CEE, del 31 de marzo de 1992, sobre medicamentos de uso humano. Desde entonces, esta asociación empresarial ha ido analizando, revisando y poniendo al día su autorregulación ética y deontológica, con objeto de dar respuesta a cualquier cuestión que se pueda presentar y dando pautas de actuación y reglas claras y concretas que deben guiar la conducta de los laboratorios en su relación con los profesionales sanitarios. Nace así en 2002 el ya mencionado Código de Buenas Prácticas de la Industria Farmacéutica, cuya última actualización (aprobada en 2014) se fundamenta en tres áreas: la promoción de medicamentos de prescripción, la interrelación con los profesionales y organizaciones sanitarias y la interrelación con las organizaciones de pacientes.
5. Deontología profesional en Información Médica.
Llegamos al momento de analizar la deontología profesional dentro del ámbito de la Información Médica.
En primer lugar, diremos que la británica Pharmaceutical Information and Pharmacovigilance Association (PIPA), en su guía de buenas prácticas (PIPA 2013), denomina Información Médica a la “información actualizada y de alta calidad sobre medicamentos y dispositivos necesaria para optimizar su uso seguro y eficaz en el tratamiento de los pacientes”. Esta información puede referirse tanto a aspectos clínicos como técnicos.
Además, llamaremos área de Información Médica a aquel departamento o sección de una compañía farmacéutica o biomédica dedicado (aunque no necesariamente en exclusiva) a proporcionar bajo demanda, a profesionales sanitarios o pacientes, información sobre los medicamentos que comercializa. Y definiremos como Técnico de Información Médica a aquel profesional dedicado a proporcionar bajo demanda información médica a profesionales sanitarios, instituciones o pacientes.
Si bien las recomendaciones de la U.S. Federal Drug Administration (FDA) quedan fuera de la normativa europea, tanto en lo que se refiere a la legislación aplicable como a las prácticas profesionales permitidas a y por la industria farmacéutica, no queremos dejar de referirnos a los borradores de dos documentos almacenados en su página web, distribuidos con el fin de recibir comentarios por parte de los actores afectados. Hasta donde sabemos, aún no están disponibles (ni aprobadas) sus versiones definitivas:
- Guidance for Industry Responding to Unsolicited Requests for Off-Label Information About Prescription Drugs and Medical Devices (Guía para la industria sobre respuesta a las peticiones de información fuera de indicación sobre medicamentos con receta y productos sanitarios) (FDA 2011).
- Guidance for Industry Distributing Scientific and Medical Publications on Unapproved New Uses (Guía para la industria sobre distribución de publicaciones científicas y médicas sobre nuevos usos no aprobados) (FDA 2011).
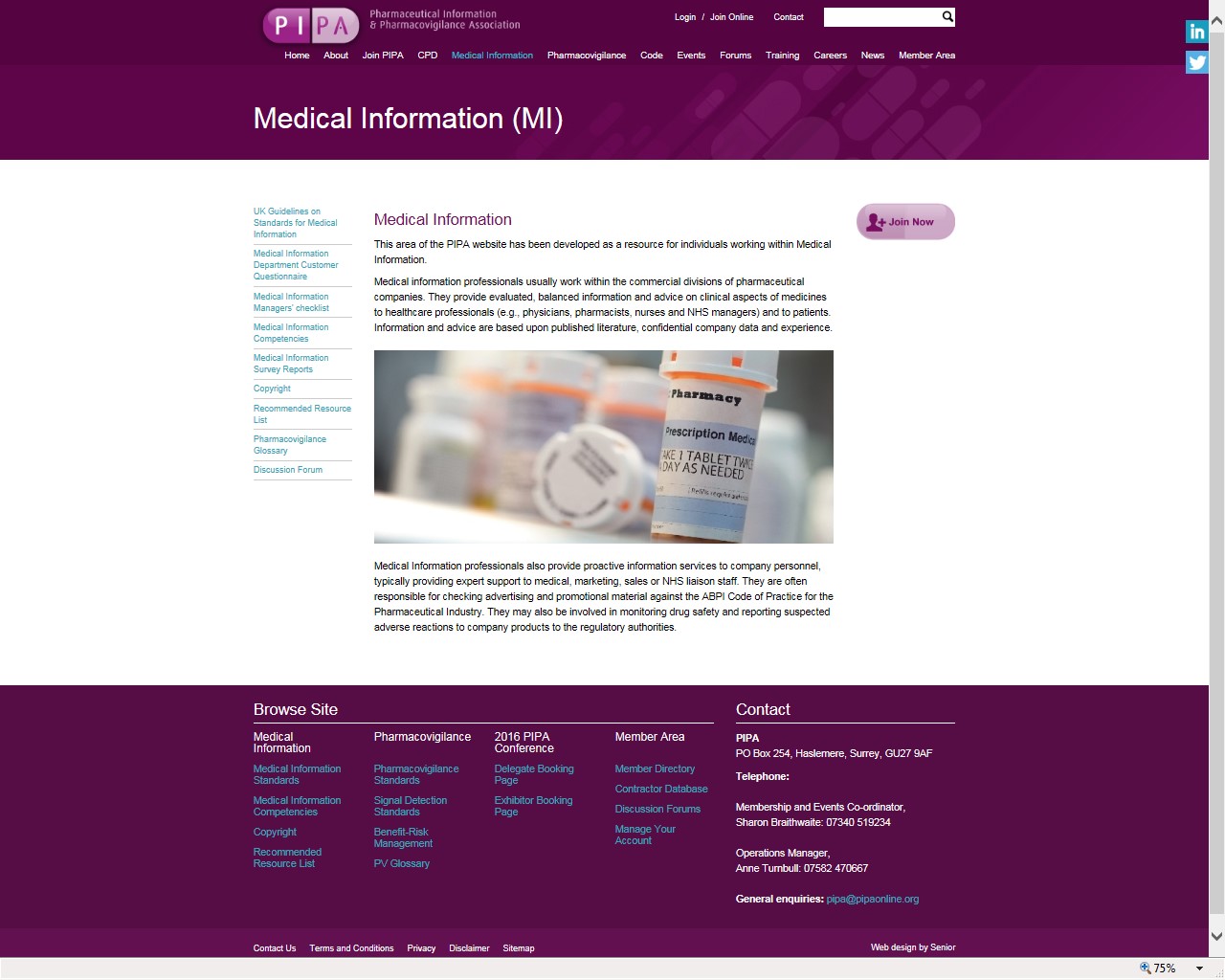
Ya en Europa, a principios de la década de 1970, los técnicos de información de la industria farmacéutica del Reino Unido se hicieron conscientes de la necesidad de intercambiar ideas y experiencias que fomentaran su desarrollo profesional, organizándose en la anteriormente mencionada PIPA (Figura 5). Esta asociación representa hoy a más de 800 miembros que trabajan en gran variedad de funciones de gestión de la información en la industria farmacéutica, tales como la información médica, la farmacovigilancia, la información de la investigación científica y la información comercial. Un número creciente de miembros provienen de compañías de fuera del Reino Unido, así como de agencias, empresas consultoras y proveedores de servicios.
Figura 5. Medical Information web page en la web de la Pharmaceutical Information and Pharmacovigilance Association. http://www.pipaonline.org/Medical-Information-MI-
La primera versión de la Guía de Buenas Prácticas para los Departamentos de Información Médica de la Industria Farmacéutica de la PIPA fue aprobada en 1995, y la actualización actualmente en vigor tiene fecha de 2013. De gran exhaustividad, hace un recorrido por todas las áreas, procesos, actividades y actores involucrados en la Información Médica. Dado que esta guía está disponible en www.pipaonline.org, nos limitaremos a indicar al lector los aspectos que nos parecen más destacables, remitiéndole al texto completo si desea ampliar la información:
- Acceso al servicio: las empresas deben tener un área claramente identificada desde la que dar respuesta a las consultas médicas, farmacéuticas y técnicas relativas a sus productos.
- Gestión de consultas: las empresas deben disponer de procedimientos detallados sobre cómo responder a las preguntas de los profesionales de la salud y los pacientes, sea cual sea el medio a través del cual se reciban (teléfono, carta, fax, e-mail, etc.). Además, es fundamental que los profesionales involucrados en la Información Médica hayan sido entrenados para reconocer posibles efectos adversos de los medicamentos comercializados por las compañías farmacéuticas a las que pertenecen. En el caso de que la Información Médica sea proporcionada por un servicio externo a la compañía (outsourcing), ésta deberá definir y asegurarse del cumplimiento de prácticas y recursos que garanticen los estándares de la industria, la legislación y la empresa.
- Información para los profesionales de la salud: las empresas deberán proporcionar a los profesionales sanitarios que lo soliciten las fichas técnicas, prospectos y otra información técnica necesaria para el conocimiento de los medicamentos y dispositivos comercializados (en especial sobre disponibilidad, contraindicaciones, advertencias y efectos adversos), así como cualquier otra información esencial para el buen uso de sus productos. En caso de que sea un paciente el que pregunta sobre el uso un medicamento que le ha sido prescrito, la compañía le proporcionará datos objetivos, remitiéndole al profesional sanitario para cualquier pregunta o decisión sobre el tratamiento del que éste es responsable.
- Información sobre aspectos no incluidos en la autorización de comercialización de un medicamento (comúnmente denominada off-label o fuera de indicación): sólo podrá ser suministrada en respuesta a una consulta específica por parte del profesional sanitario, y deberá ser proporcionada desde los Departamentos Médicos o de Información Médica de la compañía. Asimismo, es importante que el médico que hace la consulta sea plenamente consciente de que el uso de un producto “fuera de indicación” es responsabilidad del prescriptor.
- Consultas de pacientes y público en general: deberán ser contestadas según las normas establecidas en el Código de Buenas Prácticas de la industria, y siempre en cumplimiento de la legislación vigente. En cualquier caso, la información proporcionada no deberá ser promocional ni hará referencia a la eficacia o seguridad de un fármaco. Además, “cualquier pregunta sobre su uso por pacientes con enfermedades concomitantes o que tomen otros medicamentos deberá ser remitida a un médico, farmacéutico u otro profesional de la salud”, y cualquier sospecha de efecto adverso será comunicada según los procedimientos establecidos.
- Cualificación y formación de los profesionales de IM: los profesionales deben tener la formación necesaria para proporcionar un servicio de Información Médica adecuado y de calidad. Se recomienda establecer claramente la definición de los puestos y el establecimiento de planes de desarrollo profesional de los técnicos.
- Calidad del servicio: además de un alto nivel de atención al cliente, una actitud considerada y responsable y unas adecuadas habilidades de comunicación efectiva por parte de los TIM, las áreas de Información Médica deben establecer y vigilar el cumplimiento de los siguientes estándares de calidad:
- la respuesta a cualquier consulta recibida no contravendrá el Código de Buenas Prácticas pertinente u otros requisitos establecidos;
- la información suministrada debe ser precisa, justa, objetiva, sin ambigüedades, y debe reflejar con claridad toda la evidencia disponible hasta la fecha;
- cualquier comparación entre productos debe estar basada en la revisión y el reflejo objetivos de toda la evidencia, sin que se produzcan exageraciones sobre las diferencias;
- la información debe ser relevante para la investigación y las necesidades específicas del solicitante;
- se mantendrá un registro de las preguntas que requieran una búsqueda bibliográfica y, en su caso, se proporcionarán al investigador todos los detalles de la estrategia;
- el término "información médica" no debe ser usado para describir los materiales de promoción o materiales utilizados para fines promocionales;
- las empresas deberían poner en marcha un procedimiento para fomentar la información, así como hacer frente a las quejas sobre su servicio de información médica.
- Auditorías e indicadores: los Departamentos de Información Médica deben tener sistemas adecuados para monitorizar su desempeño y deben llevar a cabo auditorías internas a intervalos regulares.
Además de los puntos destacados más arriba, la guía de la PIPA establece directrices concretas sobre protección de datos y copyright, instando a los departamentos de Información Médica a cumplir escrupulosamente la legislación vigente.
Finalmente, queremos a mencionar aquí la Guide on Medical Information, de la brasileña Associação da Indústria Farmacêutica de Pesquisa (INTERFARMA 2015), una entidad sectorial sin ánimo de lucro fundada en 1990 que representa a empresas e investigadores nacionales y extranjeros encargados de la innovación en salud. Se trata de un texto claro y extremadamente práctico que incluye un capítulo titulado La Información Médica y su interfaz con las áreas internas de la Empresa Farmacéutica, en el que se recogen las actividades conjuntas con departamentos como el de Comercial, el Área Médica, el departamento de Registros, el de Farmacovigilacia y el de Atención al Cliente. Además, esta guía detalla los distintos niveles de evidencia científica disponibles (según el Oxfor Centre for Evidence-Based Medicine (OCEBM) y clasifica los distintos tipos de publicaciones científicas, mencionando incluso los nombres comerciales de las bases de datos bibliográficas más importantes.
5.1 Información fuera de indicación aprobada en Ficha Técnica (off-label).
Título aparte merece la información sobre indicaciones no autorizadas (off-label), es decir, no recogidas en la Ficha Técnica de un medicamento, dispositivo o producto sanitario: la legislación y todos los códigos éticos y deontológicos analizados recogen la prohibición expresa de promocionar cualquier producto farmacéutico para cualquier uso que no haya sido autorizado en un país por las autoridades sanitarias locales. Antes de seguir adelante, conviene recordar que en ningún caso es aceptable ninguna forma de asesoramiento sobre el tratamiento de un paciente individual, y que cualquier decisión sobre dicho tratamiento es siempre responsabilidad del prescriptor.
Dicho esto, volvamos por un momento sobre el concepto de promoción: según el epígrafe Alcance del Código HCP de la EFPIA, promoción es “cualquier actividad emprendida, organizada o patrocinada por (o bajo la autoridad de) una empresa que promueve la prescripción, dispensación, venta, administración, recomendación o consumo de su medicamento”. Sin embargo, esta asociación internacional aclara también que “no pretende restringir o regular la prestación de información médica, científica y objetiva no promocional” (EPFIA 2014).
El mismo criterio sigue la IFPMA en su Código de Buenas Prácticas, que dice textualmente lo siguiente:
“No debe promocionarse ningún producto farmacéutico para su uso en un país determinado hasta que se haya concedido en ese país la autorización de comercialización requerida para tal uso.
Esta disposición no pretende impedir el derecho de la comunidad científica y del público a estar plenamente informados acerca del progreso científico y médico. Tampoco pretende restringir un intercambio pleno y adecuado de información científica referente a un producto farmacéutico, incluida la divulgación adecuada en los medios de comunicación científicos o generales y en conferencias científicas de descubrimientos de la investigación” (IFPMA 2012).
En esa línea se manifiestan también otras organizaciones y asociaciones internacionales, como la Asociación Británica de la Industria Farmacéutica (ABPI) o la Administración Estadounidense de Medicamentos y Alimentos (FDA, por sus siglas en inglés). Y sólo la británica PIPA, en su muy detallada Guía de Buenas Prácticas para los Departamentos de IM de la Industria Farmacéutica, da indicaciones específicas sobre la denominada información off-label (PIPA 2013):
- La información proporcionada debe estar dentro de los términos de la autorización de comercialización del medicamento (licencia de producto) o el uso previsto del dispositivo. Sin embargo, se puede suministrar información relacionada con el uso fuera de indicación de un fármaco o sobre medicamentos sin licencia de comercialización, siempre en respuesta a consultas realizadas por profesionales de la salud. Dicha información será proporcionada únicamente por la empresa fabricante o comercializadora, preferiblemente a través del Departamento Médico o de Información Médica, y ha de ser objetiva, factual y no promocional. Es importante que el profesional sanitario sea plenamente consciente de que se trata de información off-label y de que el uso de un producto fuera de su licencia es responsabilidad única del prescriptor. Es asimismo importante determinar si el producto ha sido efectivamente utilizado fuera de indicación, en cuyo caso se debe informar al equipo de Farmacovigilancia.
- Se puede proporcionar al profesional sanitario información sobre medicamentos y dispositivos aún no comercializados o sobre productos sin licencia, siempre en respuesta a su consulta o solicitud. También se puede proporcionar de forma proactiva a los implicados en el lanzamiento de nuevos productos”, siempre que se cumpla con la normativa específica del Código de Buenas prácticas ABPI.
De la misma manera, Farmaindustria deja claro que su Código de Buenas Prácticas no cubre “La correspondencia, acompañada, en su caso, de cualquier documento no publicitario (por ejemplo, artículos científicos) necesario para responder a una pregunta concreta sobre un medicamento en particular, pero tan solo si se refiere a la cuestión objeto de consulta y es veraz y no engañoso” (Farmaindustria 2014). Como aportación propia, cabe resaltar que el texto español alude constantemente a las organizaciones de pacientes como agentes de pleno derecho en el ámbito de la Información Médica, junto a las compañías farmacéuticas y a las organizaciones y profesionales sanitarios.
Para finalizar este importantísimo asunto, no queremos dejar de referirnos al párrafo recogido en la Guía de Información Médica de la asociación brasileña INTERFARMA en relación con la información fuera de indicación, recomendándolo como forma de actuación aconsejable para un TIM que recibe una petición de información off-label:
“En respuesta a la solicitud (de un profesional sanitario), la empresa debe responder de forma específica a las preguntas espontáneas fuera de indicación, explicando esta condición (…). Es imperativo que el departamento de Información Médica puntualice que la empresa farmacéutica no recomienda el uso de sus productos fuera de las especificaciones que se describen en la Ficha Técnica” (INTERFARMA 2015).
Como autores de esta guía, el Foro de Información Médica de AMIFE se permite añadir a este párrafo la conveniencia de recordar al profesional que el uso de un fármaco, dispositivo o producto sanitario fuera de indicación es de responsabilidad única del prescriptor.
5.2 Deontología profesional en Información Médica en España.
Según los datos recogidos por la ya mencionada encuesta sobre Información Médica del Grupo de Trabajo de AMIFE, el 72,5 % de las empresas farmacéuticas españolas disponen de un área o departamento de Información Médica, el 30% de los cuales fue creado hace más de 10 años. De hecho, este servicio se ha convertido en un valor añadido que la Industria Farmacéutica aporta a los profesionales sanitarios, quienes confían cada vez más en los datos que reciben de estos departamentos. En nuestra opinión, este aumento de la confianza se debe a la alta calidad y utilidad de los servicios que proporcionan, así como al alto grado de cualificación y profesionalidad de los TIM.
La gran mayoría de los TIM españoles (el 86%, según la encuesta de AMIFE) son licenciados de la rama biosanitaria. A falta de opciones más ajustadas a su desempeño laboral, se han venido afiliando tradicionalmente a organizaciones que aglutinan a otros profesionales de la industria farmacéutica. Así, durante los primeros años del siglo XXI, existió un Grupo de Trabajo de Información Médica de la Asociación Española de Farmacéuticos de la Industria (AEFI), que reunió por primera vez en España a estos profesionales para poner en común sus actividades y conocimientos. Con los datos de una encuesta promovida a finales de 2003, los integrantes de este grupo proporcionaron la primera descripción de la Información Médica española (Tabuenca-Cortés et al. 2004).
Pero este altamente especializado sector carece en nuestro país de una guía ética profesional propia, ya que el Código de Buenas Prácticas de Farmaindustria no recoge apenas ninguna referencia a la relación entre el área de Información Médica y los profesionales sanitarios. Creemos que esto se debe, en parte, a que no existen en España asociaciones profesionales específicas, por lo que los textos disponibles se refieren mayoritariamente a la profesión bibliotecaria pública y no incluyen referencias a un ámbito técnico tan concreto y que no puede olvidar su compromiso con la ética empresarial. A este respecto, conviene recordar que, cada vez con mayor frecuencia, la industria farmacéutica dispone de Procedimientos Normalizados de Trabajo (PNT) sobre Información Médica. En ellos se describen los procesos, los recursos y los controles necesarios para garantizar un servicio de calidad, pero no pueden sustituir a la profunda reflexión ética de un código deontológico que no sólo certifica la calidad del servicio, sino que también define los derechos y deberes bajo los que el profesional debe desarrollar su actividad, con garantía para sí mismo y para los otros.
6. En el camino hacia un código español de buenas prácticas.
Es en este contexto en el que se inicia hace casi dos años la andadura del Grupo de Información Médica de AMIFE. Ya durante las primeras reuniones, sus miembros ponen de manifiesto la conveniencia de dotarse de una Guía de Buenas Prácticas, comprometiéndose en la reflexión ética necesaria para su elaboración. En el momento de publicación de este artículo, un subgrupo de 15 profesionales se encuentra inmerso en la redacción de un texto específico basado en los principales códigos deontológicos internacionales, que incluirá las escasas referencias legales existentes y que se adaptará a las particularidades nacionales y a las necesidades específicas de los profesionales españoles. Como consecuencia y resumen de la mencionada reflexión ética, el texto expondrá una serie de conclusiones y/o recomendaciones que definan y orienten las obligaciones y actividades de la Información Médica, así como una primera propuesta de Procedimiento Normalizado de Trabajo
Mientras llega el momento de su presentación, prevista para finales de 2016, este grupo de trabajo recomienda a los departamentos de IM de la industria farmacéutica española el cumplimiento de los siguientes códigos deontológicos, además de la legislación vigente:
- Código de Buenas Prácticas de Farmaindustria, que supone un esfuerzo deontológico vivo y actualizado sobre la promoción de medicamentos por parte de la Industria Farmacéutica española, si bien no entra a considerar la ética ni las actividades propias de la Información Médica.
- Guía de Buenas Prácticas de la PIPA, que constituye un conjunto de normas accesibles e indicativas de una alta calidad en los servicios de Información Médica de las empresas farmacéuticas, y
- Código de conducta para mediadores de información de EUSIDIC, que incluye los aspectos empresariales de las actividades relacionadas con la Información científica.
Finalmente, consideramos conveniente conocer, y en su caso aplicar en lo posible, las indicaciones éticas, deontológicas y profesionales recogidas en la Guía de Información Médica de la asociación brasileña INTERFARMA, ya que se trata de un texto muy práctico y adaptado a la actividad diaria de los Técnicos de Información Médica.
Miembros del Grupo de Trabajo de Información Médica de la Asociación de Médicina de la Industria Farmacéutica (AMIFE):
Eva Badia Manaut. Kern Pharma
Sylvaine Balmy. Boiron SIH, S.A
Lurdes Cabo Domínguez. Sanofi España, S.A.
Enrique Cavada García. AbbVie
Marta Del Cano Miquel. AstraZeneca Farmacéutica Spain, S.A.
María Lourdes Díaz Trujillo. Eisai Farmacéutica, S.A.
Nuria Escudero Galán. Meisys, S.L.
Ángela Flores Canoura. Lilly S.A. (moderadora)
Jaime Fragoso De Castro. Sermes Consulting para GSK
Daniel García Ortiz. Teva Parma, S.L.
Elena Guardiola Pereira. Bayer Hispania, S.L.
María Ángeles Hernández. Gilead Sciences
Inmaculada Iglesias Puente. Janssen-Cilag, S.A.
Anna Jurczynska Romanek. AMIFE (moderadora)
Ana López Rico. Merck España, S.A.
Aitor Martínez Rosell. Celgene España, S.L.
Patricia Ortega Muñoz. Meisys, S.L. (moderadora)
Tamara Pozo Rubio. Takeda Farmacéutica España, S.A.U.
Fernanda Pulido Velasco. Anaxomics Biotech, S.L.
Mónica Rodríguez Sangrador. Danone Nutricia Early Life Nutrition
Mónica Rojo Abril. Grünenthal Pharma, S.A.
María San Martín Rodríguez. Sanofi Pasteur MSD, S.A.
Carina Zabena. PRA Health Sciences para MSD España
Descargo de responsabilidad
La responsabilidad de las opiniones expresadas en este artículo recae únicamente en su autora, y no representa ni constituye una aprobación de dicha opinión por parte de ninguna empresa u organización.
Bibliografía:
AMERICAN LIBRARY ASSOCIATION. [sitio web]. 2006. Code of Ethics of the American Library Association. Chicago IL: ALA. 2016. [Consulta 10 mayo 2016]. Disponible en: http://www.ala.org/advocacy/proethics/codeofethics/codeethics
ASOCIACIÓN MULTISECTORIAL DE LA INFORMACIÓN, 2001. Código ético del sector de servicios de información electrónica. En: DOMÍNGUEZ-SÁNCHEZ, P y GARCÍA-DE PASO, E (coord). Códigos de ética y deontología profesional. Selección, traducción y edición crítica. Boletín de la ANABAD. 2001;51(3); 135-145. ISSN 0210-4164
ASSOCIAÇÃO DA INDÚSTRIA FARMACÊUTICA DE PESQUISA. [sitio web]. 2015. Guia de Informações Médicas. Sao Paulo, Brasil: INTERFARMA. 2015. [Consulta: 10 mayo 2016]. Disponible en: http://www.interfarma.org.br/uploads/biblioteca/71-guia-de-informacoes-medicas-site.pdf
ASSOCIAÇÃO DA INDÚSTRIA FARMACÊUTICA DE PESQUISA. [sitio web]. 2015. Guia de Informações Médicas, p. 9. Sao Paulo, Brasil: INTERFARMA. 2015. [Consulta: 10 mayo 2016]. Disponible en: http://www.interfarma.org.br/uploads/biblioteca/71-guia-de-informacoes-medicas-site.pdf
ASSOCIAÇÃO PORTUGUESA DE DOCUMENTAÇÃO E INFORMAÇÃO NA SAÚDE, ASSOCIAÇÃO PORTUGUESA DE BIBLIOTECÁRIOS, ARQUIVISTAS E DOCUMENTALISTAS y ASSOCIAÇÃO PORTUGUESA PARA O DESENVOLVIMENTO DA INFORMAÇÃO CIENTÍFICA E TÉCNICA. 1999. Código de ética. Apbad.pt [sitio web] Lisboa: BAD. 2016. [Consulta 10 mayo 2016). Disponible en: http://www.apbad.pt/Downloads/codigo_etica.pdf
COL'LEGI OFICIAL DE BIBLIOTECARIS-DOCUMENTALISTES DE CATALUNYA. [sitio web]. 2016 Codi deontològic. Barcelona: COBDC. [Consulta: 10 mayo 2016]. Disponible en: http://www.cobdc.org/collegi/codi_deontologic.html
EUROPEAN ASSOCIATION OF INFORMATION SERVICES. [sitio web]. 1994. Código de conducta para mediadores de información. Traducción del Centro de Información y Documentación Científica y Doc6. Madrid. 2014. [Consulta: 10 mayo 2016]. Disponible en: http://digital.csic.es/bitstream/10261/36897/1/CodigoDeontologico.pdf
EUROPEAN FEDERATION OF PHARMACEUTICAL INDUSTRIES AND ASSOCIATIONS. [sitio web]. 2014. EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals. Final consolidated version 2013. Bruselas: EFPIA. 2016. [Consulta: 10 mayo 2016]. Disponible en: http://transparency.efpia.eu/uploads/Modules/Documents/efpia-hcp-code-2014.pdf
EUROPEAN FEDERATION OF PHARMACEUTICAL INDUSTRIES AND ASSOCIATIONS. [sitio web]. 2014. EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals. Final consolidated version 2013. Brussels: EFPIA. 2016, p. 4. [Consulta: 10 mayo 2016]. Disponible en: http://transparency.efpia.eu/uploads/Modules/Documents/efpia-hcp-code-2014.pdf
FARMAINDUSTRIA [sitio web]. 2014. Código de Buenas Prácticas de la Industria Farmacéutica. Madrid: Farmaindustria. 2016, p. 8. [Consulta: 10 mayo 2016]. Disponible en: http://www.farmaindustria.es/web/wp-content/uploads/sites/2/2014/02/C%C3%B3digo-de-Buenas-Pr%C3%A1cticas-de-la-Industria-Farmac%C3%A9utica.pdf
FARMAINDUSTRIA. [sitio web]. 2014. Código de Buenas Prácticas de la Industria Farmacéutica. Madrid: Farmaindustria. [Consulta: 10 mayo 2016]. Disponible en: http://www.farmaindustria.es/web/wp-content/uploads/sites/2/2014/02/C%C3%B3digo-de-Buenas-Pr%C3%A1cticas-de-la-Industria-Farmac%C3%A9utica.pdf
FLORES M.A y BALMY S., on behalf of the Spanish Medical Association of the Pharmaceutical Industry (AMIFE) Medical Information Working Group. 2014. Medical Information departments within the pharmaceutical industry in Spain. En: 9th Annual Medical Information and Communications Conference, november 10-11 2015. London, UK: Drug Information Association.
INTERNATIONAL FEDERATION OF LIBRARY ASSOCIATIONS AND INSTITUTIONS.[sitio web], 2012 Código de ética de la IFLA para bibliotecarios y otros trabajadores de la información (versión completa). La Haya: IFLA. 2012. [Consulta: 10 mayo 2016). Disponible en: http://www.ifla.org/files/assets/faife/codesofethics/spanishcodeofethicsfull.pdf
INTERNATIONAL FEDERATION OF PHARMACEUTICAL MANUFACTURERS & ASSOCIATIONS. [sitio web]. 2012. Código IFPMA de Buenas Prácticas. Geneva: IFPMA. 2012. [Consulta: 2 junio 2016]. Disponible en: http://www.ifpma.org/wp-content/uploads/2016/01/Código_IFPMA_de_Buenas_Prácticas_2012_new_logo.pdf
INTERNATIONAL FEDERATION OF PHARMACEUTICAL MANUFACTURERS & ASSOCIATIONS. [sitio web]. 2012. Código IFPMA de Buenas Prácticas. Geneva: IFPMA. 2012, p. 5. [Consulta: 2 junio 2016]. Disponible en: http://www.ifpma.org/wp-content/uploads/2016/01/Código_IFPMA_de_Buenas_Prácticas_2012_new_logo.pdf
LÓPEZ-LÓPEZ, P y VIVES-GRÀCIA, J. 2013. Ética y derechos humanos para bibliotecas y archivos. Salamanca: Federación Española de Asociaciones de Archiveros, Bibliotecarios, Arqueólogos, Museólogos y Documentalistas (ANABAD). p. 147. Logroño: Fundación DialNet [sitio web]. 2016. [Consulta: 2 junio 2016]. Archivo PDF. Disponible en: https://dialnet.unirioja.es/descarga/libro/556478.pdf
ORGANIZACIÓN MUNDIAL DE LA SALUD [sitio web]. 1988. Criterios éticos para la promoción de medicamentos. [Consulta: 5 mayo 2016]. Disponible en: http://apps.who.int/medicinedocs/es/d/Jwhozip09s/#Jwhozip09s
PÉREZ-PÙLIDO, M y FERNÁNDEZ-FERNÁNDEZ CUESTA, P; en representación del Grupo de Trabajo de Ética Profesional de la Asociación Española de Documentación e Información, 2011. Hacia un código deontológico común para los profesionales de la gestión de la información: Resultado de la encuesta. En: XII Jornadas Españolas de Documentación. 25-27 de mayo. Málaga, España.
PHARMACEUTICAL INFORMATION AND PHARMACOVIGILANCE ASSOCIATION. [sitio web]. 2013. UK Guidelines for the Pharmaceutical Industry Medical Information Departments. Haslemere, Surrey: 2016. [Consulta: 10 mayo 2016]. Disponible en: www.pipaonline.org
PHARMACEUTICAL INFORMATION AND PHARMACOVIGILANCE ASSOCIATION. [sitio web]. 2013. UK Guidelines for the Pharmaceutical Industry Medical Information Departments. Haslemere, Surrey: 2016, p. 6. [Consulta: 10 mayo 2016]. Disponible en: www.pipaonline.org
ESPAÑA 1994. Real Decreto 1416/1994, de 25 de junio, por el que se regula la publicidad de los medicamentos de uso humano. Boletín Oficial del Estado [en línea], 180, de 29 de julio de 1994, pp. 24404-24410. [Consulta: 2 junio 2016]. Versiones html, pdf, con texto consolidado. Disponible en: https://www.boe.es/boe/dias/1994/07/29/pdfs/A24404-24410.pdf
ESPAÑA 2015. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. Boletín Oficial del Estado [en línea], 77, de 25 de julio de 2015, pp. 62935-63030. [Consulta: 2 junio 2016]. Versiones html, pdf, epub, con texto consolidado. Disponible en: https://www.boe.es/diario_boe/txt.php?id=BOE-A-2015-8343
SOCIEDAD ESPAÑOLA DE DOCUMENTACIÓN E INFORMACIÓN CIENTÍFICA. [sitio web]. 2013 Código Deontológico. Madrid: SEDIC. 2013[Consulta: 5 mayo 2016]. Disponible en: http://www.sedic.es/wp-content/uploads/2015/11/codigo_deontologico_sedic.pdf
SOCIEDAD ESPAÑOLA DE DOCUMENTACIÓN E INFORMACIÓN CIENTÍFICA [sitio web]. 2016. Grupo Ética Profesional. Madrid: SEDIC [Consulta: 5 mayo 2016]. Disponible en: http://www.sedic.es/profesionales/grupos-de-trabajo/grupo-etica-profesional/
TABUENCA-CORTÉS, M., CASAS-GÁLVEZ, I., FRAGOSO-DE CASTRO, J. y OYAGÜEZ-MARTÍN, I.; en nombre del Grupo de Trabajo de Información Médica de AEFI, 2004. La Información Médica en el entorno de la industria farmacéutica. En: XXIV Simposium AEFI. Innovación farmacéutica en la nueva Europa. 18-19 noviembre. Córdoba, España.
U.S. FEDERAL DRUG ADMINISTRATION. [sitio web]. 2011. Guidance for Industry Distributing Scientific and Medical Publications on Unapproved New Uses. Revised Draft Guidance. Silver Spring, MD: 2016. [Consulta: 10 mayo 2016]. Disponible en: http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm387652.pdf
U.S. FEDERAL DRUG ADMINISTRATION, 2011. Guidance for Industry Responding to Unsolicited Requests for Off-Label Information About Prescription Drugs and Medical Devices. Draft Guidance. Silver Spring, MD: 2016. [Consulta: 10 mayo 2016]. Disponible en: http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm285145.pdf
VÁZQUEZ, E. 2011. Reflexiones sobre deontología judicial. En: F.G. CAMPOS, D CIENFUEGOS, L.G. RODRÍGUEZ, J ZARAGOZA (coord). Entre libertad y castigo: Dilemas del Estado contemporáneo [en línea]. Méjico DF: Universidad Nacional Autónoma de México. pp. 37-843. [Consulta: 13 septiembre 2015]. Disponible en: http://biblio.juridicas.unam.mx/libros/7/3104/50.pdf
Enlaces refback
- No hay ningún enlace refback.
Copyright (c)

Este trabajo está licenciado bajo la licencia Creative Commons Attribution 3.0 .
ISSN: 2173-1241